الکترون داخل دو پوسته ی میدان ترک می کند. شما یک اتم خوشحال هستید، اکنون شما یک یون هستید و یک الکترون از دست داده اید.
شما یک یون سدیم هستید (NA+). شما یک الکترون کمتر از عدد اتمی تان دارید.
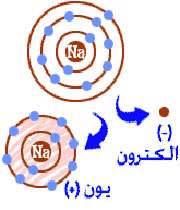
ویژگی های یون:
اکنون شما یک یون سدیم شده اید (+NA). اکنون شما ده الکترون دارید. این عدد مشابه نئون (Ne) نیز هست. اما شما نئون نیستید. زمانی که شما یک الکترون را از دست می دهید شما واقعا یک اتم کامل سدیم نیستید. تمام هدف شما به عنوان یک اتم برای تبدیل شدن به یک اتم خوشحال با اوربیتال های پر از الکترون، یک یون بودن است.
حال شما آن پوسته های میدان را پر کرده اید.
شما پایدار هستید. در این وضعیت شما چه کاری انجام می دهید؟ اکنون شما الکترون از دست می دهید شما کاملا از لحاظ الکتریکی جذب کننده هستید.
اتم های باردار دیگر در حال نگاه کردن به شما هستند. همچنین در جستجوی یک شریک خوب هستند. آن جایی است که کلر وارد می شود.
الکترووالانس
درباره این کلمه بزرگ نگران نشوید.
الکترووالانس فقط یک کلمه دیگر برای چیزهایی است که الکترون خود را از دست می دهند و به یون تبدیل می شوند.
اگر شما به جدول تناوبی نگاه کنید ممکن است که ببینید تمام عناصری که سمت چپ قرار دارند به یون با بار مثبت و عناصری که در سمت راست قرار دارند به یون با بار منفی تبدیل می شوند.
این بدین معنی است که سمت چپ تمایل به مثبت بودن و سمت راست تمایل به منفی بودن دارند. والانس یک مشخصه برای نشان دادن تمایل اتم ها برای ارتباط با دیگر اتم هاست.

دو نوع پیوند اصلی وجود دارند. کووالانس و الکترووالانس. دانشمندان پیوند یونی را پیوند الکترووالانس نیز می نامند. پیوند یونی، گروه های یون های بارداری هستند که به وسیله نیروی الکتریکی در کنار هم نگه داشته می شوند. دانشمندان این گروه ها را تجمع های های یونی نامیده اند. در حضور یون های دیگر، پیوندهای الکترووالانس بدلیل وجود جاذبه و نیروهای الکتریکی بیرونی ضعیفتر هستند.
به عنوان نمونه به سدیم کلراید نگاه کنید. نمک، پیوند قوی ای دارد. تقریبا شکسته شدن پیوندهای یونی آن غیر ممکن است. هر چند اگر شما نمک را در مقداری آب بریزید پیوندهای آن به علت جاذبه الکتریکی آب به سرعت می شکند. حال شما یون های سدیم (+Na) و کلراید (-Cl) دارید. به خاطر داشته باشید به طور نرمال پیوندهای یونی قوی تر هستند اما در آب بسیار ضعیف می باشند.

منبع:http://shimidanejavan1.persianblog.ir
نظرات شما عزیزان:
موضوعات مرتبط: شيمي ، ،
برچسبها:



 آمار
وب سایت:
آمار
وب سایت: